HIF-1 и метаболиты гликолиза: при чем тут миноксидил?
Тема этой статьи родилась при обдумывании того факта, что коммерческие компании, разрабатывающие продукцию трихологической направленности, предлагают к использованию условные заменители старых добрых миноксидила и финастерида. Происходит это на фоне неких действий в общественном информационном пространстве, которые по своей сути являются демонизацией указанных препаратов. Однако миноксидил и финастерид давно доказали свою неиллюзорную эффективность в лечении выпадения волос, это подтверждено многими независимыми исследованиями. Что немаловажно: изучаются механизмы, приводящие к такому результату. И более того, результаты исследований есть в открытом доступе, где любой интересующийся может их найти. Возникает закономерный вопрос: будут ли продвигаемые фирмами заменители обладать той же эффективностью? И если да, то за счет чего?
Для не-врачей напомню, что миноксидил - это специально придуманное вещество, то есть молекула, имеющая специфическую структуру и за счет этой структуры обладающая биологической активностью. Биологически активные молекулы, попадая в клетки, связываются с теми или иными находящимися в той же клетке другими молекулами и тем самым либо активизируют что-то нужное, либо угнетают что-то ненужное. Всегда хорошо знать, с чем конкретно эти молекулы связываются и каким именно путем они что-то активируют или угнетают, потому что на уровне клетки становятся очень важными любые сдвиги в концентрациях постоянно образующихся в ней веществ - потому что в конечном итоге именно эти сдвиги перепрограммируют клетку.
Считается, что миноксидил расширяет кровеносные сосуды и тем самым реализует свое действие. Фирменные миноксидилозаменители вроде бы выполняют ту же функцию. Однако ограничивается ли действие миноксидила только лишь расширением сосудов? В самом волосяном фолликуле никаких сосудов нет. Однако фолликул в фазе роста окружен сосудами, более того, сам фолликул обладает свойством стимулировать ангиогенез за счет экспрессии фактора VEGF [1]. На протяжении всего фолликулярного цикла происходит ремоделирование сосудистой сетки, окружающей фолликул, следующим образом:
- во время анагена общий размер сосудистой сетки увеличивается (по некоторым сведениям, более чем в 4 раза);
- во время катагена и телогена ее размеры быстро уменьшаются.
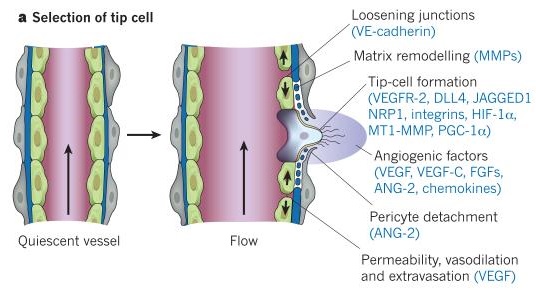
Перечисленные изменения коррелируют с изменением размера фолликула, а также с изменениями в экспрессии VEGF в кератиноцитах внешней корневой оболочки фолликула (outer root sheath) и в волосяном сосочке (dermal papilla) [1]. Другими исследованиями было показано, что миноксидил как биологически активная молекула в свою очередь влияет на экспрессию VEGF в клетках волосяного сосочка, увеличивая ее [2]. А увеличение экспрессии VEGF ведет к образованию дополнительных сосудов на базе уже имеющихся [7].
Однако интересно рассмотреть, каким именно образом миноксидил это делает. И тут уже нужно принимать во внимание немного другие факторы, влияющие на жизнедеятельность клеток, что и сделала группа корейских исследователей [3] в 2018 году.
Исследователи сосредоточились на факторе транскрипции HIF-1 (hypoxia-inducible factor-1). Этот фактор представляет собой комплекс, состоящий из двух субъединиц: протеинов HIF-1-альфа и HIF-1-бета. Что такого интересного в этом комплексе? Во-первых, этот фактор активирует целый ряд регуляторов кислородного снабжения, включая VEGF - то есть является звеном некоего сигнального пути. Во-вторых, этот фактор регулирует направленность клеточного метаболизма путем переключения обмена пирувата с одного метаболического пути на другой - то есть является метаболическим регулятором.
Если фактор транскрипции HIF-1 активен, то он активирует транскрипцию целого ряда генов, среди которых VEGF, транспортеры глюкозы, а также гликолитические ферменты. Каким образом активируется фактор HIF-1? Его активация зависит напрямую от поступления O2 в клетку. При высоком уровне O2 HIF-1 в клетках уничтожается, поскольку его активная субъединица HIF-1-альфа гидроксилируется пролил-гидроксилазами. Это группа ферментов, которым, во-первых, нужен альфа-кетоглутарат в качестве кофактора, а во-вторых, активность фермента зависит от состояния железа, входящего в его активный центр [5]. HIFы могут быть активированы и в негипоксических условиях, если будут ингибированы пролил-гидроксилазы, и это умеют делать специальные вещества-миметики, либо это получается при определенной концентрации определенных метаболитов.
Вспомним, что есть три класса ферментов, работающих похожим образом: пролил-гидроксилазы, задействованные в деградации HIF-1 и синтезе коллагена, протеины семейства ТЕТ и деметилазы семейства JmjC. Последние две группы ферментов участвуют в эпигенетическом регулировании экспрессии генов. Все эти ферменты расщепляют молекулярный кислород на два атома, один из которых образует связь с атомом железа в активном центре фермента и окисляет Fe2+ до Fe4+, а второй атом кислорода уходит в образование CO2 в процессе окислительного декарбоксилирования альфа-кетоглутарата до сукцината, оставляя железо в каталитически неактивном состоянии Fe3+. Соответственно активность фермента падает, когда становится мало альфа-кетоглутарата, и/или когда железо не восстанавливается (либо заменяется другим металлом, например кобальтом или медью). Вспомним также, что для восстановления железа обратно в двухвалентное состояние требуется аскорбат (витамин C) [6, 8].
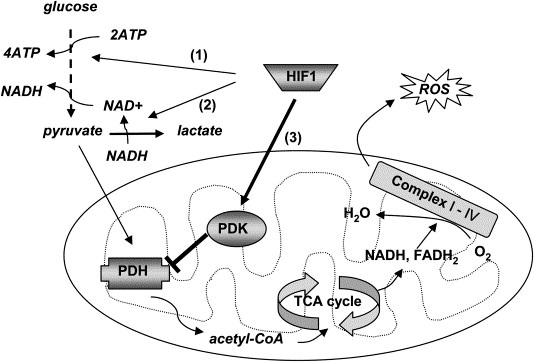
Существуют данные о том, что HIF-1 активирует транскрипцию гена пируватдегидрогеназы киназы-1 (PDK-1). Этот фермент замечателен тем, что он инактивирует пируватдегидрогеназу (путем фосфорилирования), а оная дегидрогеназа, соответственно, необходима для окислительного декарбоксилирования пирувата до ацетогруппы и вместе с коферментом А этот комплекс образует ацетил-коА, то есть точку входа в цикл Кребса [4]. Если PDK-1 инактивирована, то пируват превращается в лактат. Лактат же, в свою очередь, тоже стимулирует ангиогенез [10].
А теперь вернемся к миноксидилу. Как показано в [3], миноксидил с большой вероятностью действительно ингибирует пролил-гидроксилазу (PHD), причем делает это в концентрациях, достижимых при наружном нанесении на кожу. Механизм ингибирования скорее всего заключается в сохранении железа в активном центре фермента в окисленном, а значит, неактивном состоянии. Такой вероятный механизм действия подтверждается тем, что аскорбат (витамин C) одновременно с миноксидилом обнуляет эффект ингибирования.
И вот миноксидил ингибирует PHD -> HIF-1 не уничтожается -> живой HIF-1 активирует транскрипцию VEGF и PDK-1 -> с одной стороны активизируется сигнальный путь, а с другой - метаболический (сдвиг в сторону анаэробного гликолиза -> возрастает концентрация лактата -> ангиогенез, а если клетка стволовая - то NAD+ через SIRT1 стимулирует дифференциацию). Как-то так.

А волосы - растут. Конечно, не у 121% применявших продукт, но все-таки.
Литература:
-
Kiichiro Yano, Lawrence F. Brown, Michael Detmar
Control of hair growth and follicle size by VEGF-mediated angiogenesis -
Lachgar S, Charveron M, Gall Y, Bonafe JL.
Minoxidil upregulates the expression of vascular endothelial growth factor in human hair dermal papilla cells. -
Soohwan Yum, Seongkeun Jeong, Dohoon Kim, Sunyoung Lee, Wooseong Kim, Jin-Wook Yoo, Jung-Ae Kim, Oh Sang Kwon, Dae-Duk Kim, Do Sik Min, Yunjin Jung
Minoxidil Induction of VEGF Is Mediated by Inhibition of HIF-Prolyl Hydroxylase -
Jung-whan Kim, Irina Tchernyshyov, Gregg L. Semenza, Chi V. Dang
HIF-1-mediated expression of pyruvate dehydrogenase kinase: A metabolic switch required for cellular adaptation to hypoxia -
Christian M. Metallo, Matthew G. Vander Heiden
Understanding metabolic regulation and its influence on cell physiology -
Juan I. Young, Stephan Züchner, Gaofeng Wang
Regulation of the Epigenome by Vitamin C -
Peter Carmeliet and Rakesh K. Jain
Molecular mechanisms and clinical applications of angiogenesis -
Ryan Janke, Anne E. Dodson, Jasper Rine
Metabolism and Epigenetics -
Peter Fraisl, Massimiliano Mazzone, Thomas Schmidt, Peter Carmeliet
Regulation of Angiogenesis by Oxygen and Metabolism -
Guo-Xiang Ruan and Andrius Kazlauskas
Lactate Engages Receptor Tyrosine Kinases Axl, Tie2, and Vascular Endothelial Growth Factor Receptor 2 to Activate Phosphoinositide 3-Kinase/Akt and Promote Angiogenesis
